Forfattere
Neuroner er celler i hjernen og rygmarven, som er specialiserede i at kommunikere information i kroppen. Neuroner er vigtige for mange ting, herunder at bevæge sig, trække vejret, tænke og føle smerte. Hvis disse celler bliver skadet, f.eks. på grund af en ulykke, kan kroppen ikke længere udføre nogle af disse vigtige funktioner. Som følge heraf kan en person blive handicappet på en eller anden måde. For at hjælpe patienter med skader på hjernen eller rygmarven kan forskere og læger måske erstatte beskadigede neuroner ved at transplantere nye celler ind i den skadede person. Ved at bruge nye celler til at erstatte de neuroner, der er gået tabt på grund af skaden, er det muligt, at patienterne kan genvinde nogle af deres tabte evner, f.eks. at bevæge sig. Forskerne mener, at stamceller er den ideelle celletype at transplantere ind i skadede patienter, fordi stamceller kan formere sig og ændre sig til de forskellige celletyper, der er nødvendige for at reparere skaden. De stamceller, som forskerne transplanterer, kan fremstilles i laboratoriet ud fra hudceller og blodceller. Både hud- og blodceller kan udtages ved hjælp af en nål. I øjeblikket bruges stamceller fra patienter med hjernesygdomme som Alzheimers sygdom til at studere disse sygdomme i laboratoriet, så der kan udvikles celleerstatningsterapier.
I denne artikel vil du lære om, hvad neuroner (new-rons) er, og hvordan forskere og læger håber, at de kan bruges til at hjælpe med at reparere centralnervesystemet. Centralnervesystemet består af hjernen og rygmarven (figur 1). Neuroner er de særlige celler, der findes i disse strukturer. Hjernen og rygmarven er meget vigtige for alle mulige ting i kroppen – som at bevæge sig, trække vejret, tænke og føle smerte – og når hjernen eller rygmarven bliver skadet, kan det medføre alvorlige problemer for personen. Denne artikel vil forklare, hvordan neuroner kan bruges til at reparere disse skader, og den vil også lære dig om stamceller og hvordan nogle typer stamceller kan ændres i laboratoriet, så de bliver til neuroner, som derefter kan bruges til at hjælpe mennesker med skader i deres centralnervesystem. Endelig diskuterer artiklen, hvordan neuroner fremstillet af stamceller allerede bruges, og hvordan læger og forskere håber, at de kan bruges i fremtiden.
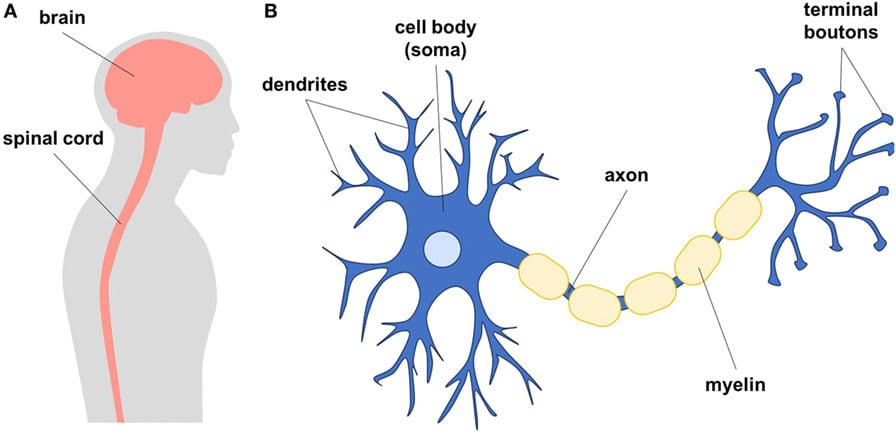
Neuroner er den vigtigste kommunikerende celletype i nervesystemet. Hvert neuron har en cellelegeme, som holder cellen i live ved at lave proteiner og energi (figur 1). Cellelegemet fungerer også som cellens hjerne, fordi det behandler al den indkommende information og fortæller neuronen, hvad den skal gøre. Fra cellelegemet forgrener lange aksoner (axoner) og dendritter sig for at sende og modtage beskeder til og fra andre celler. For enden af axonet er der strukturer, der kaldes terminale boutons, som ligner små buler. De terminale boutons kommer i kontakt med andre neuroners dendritter og danner specialiserede forbindelser, der kaldes synapser (sin-ap-sez). Når neuroner taler med hinanden, sender de elektriske eller kemiske beskeder, som kan få det næste neuron til at sende et aktionspotentiale (signal) ned gennem dets akson. På den måde kan signalet sendes langs en hel kæde af neuroner. For at fremskynde signaleringen er mange neuroner isoleret af fedtlag, der kaldes myelin, på samme måde som en ledning er isoleret. I din hjerne hjælper dine neuroner dig med at lære at læse, skrive, cykle, danne minder og endda have følelser. Neuroner er de byggesten, der gør os til dem, vi er, og som gør det muligt for de mange komplekse processer i hjernen at finde sted. Neuronale signaler kan også bevæge sig over lange afstande fra hjernen gennem rygmarven for at fortælle dine muskler, at de skal bevæge dine arme og ben. Der er også neuroner, som kan bringe information om berøring fra din hud tilbage til din hjerne.
Ved mange sygdomme i nervesystemet bliver neuroner beskadiget og dør. Forskerne kalder denne proces for neurodegeneration (new-ro-dee-gen-ner-ay-shon). De største neurodegenerative sygdomme er Alzheimers sygdom og Parkinsons sygdom. Ved Alzheimers sygdom får neurodegeneration folk til at glemme ting. Ved Parkinsons sygdom mistes neuroner i en del af hjernen, der er ansvarlig for bevægelse, og det gør det svært for disse patienter at gå og bevæge sig. Hvis nogen falder uheldigt eller kommer ud for en bilulykke, kan neuronerne også blive skadet. Hvis hovedet rammes, kalder vi det en traumatisk hjerneskade. Hvis rygmarven rammes, kalder vi det en traumatisk rygmarvsskade. Tabet af neuroner bryder den kæde af beskeder, der bevæger sig gennem nervesystemet, og som er nødvendig for normal funktion.
En mulig måde at behandle neurodegenerative sygdomme og skader i centralnervesystemet på er at erstatte døde eller beskadigede neuroner gennem celletransplantationer. Hvis nye neuroner kan erstatte de tabte, vil patienterne måske kunne genvinde funktioner som hukommelse eller bevægelse, men der er nogle vigtige udfordringer, der skal overvindes. For det første er der ingen nem måde at indsamle neuroner fra kroppen til brug i behandlingen. Der er et begrænset antal neuroner i hjernen og rygmarven, som begge er vanskelige områder at få adgang til, og neuroner vokser for det meste ikke ud igen. For det andet er neuroner ikke de eneste celler, der påvirkes af neurodegeneration. Der er andre celler i nervesystemet kendt som gliaceller som omgiver neuroner og yder støtte, beskyttelse og forsyner neuronerne med næringsstoffer. Gliaceller kan også gå tabt på grund af sygdomme og skader.
For at overvinde disse forhindringer har forskerne set på en særlig slags celler, der kaldes stamceller, og som kan gøre to vigtige ting. Stamceller kan forny sig selv hvilket betyder, at de hele tiden kan lave nye kopier af sig selv; og stamceller kan differentiere sig (dif-ur-en-shee-ate), hvilket betyder, at de kan omdannes til andre typer celler. Den første studerede stamcelle var den embryonale stamcelle (ESC). ESC’er er pluripotente hvilket betyder, at de kan differentiere sig til enhver celletype i kroppen, fra hjerteceller til hjerneceller til muskelceller (figur 2). Men ESC’er kan ikke fremstilles af dine egne celler – de skal komme fra embryoner, og derfor er kilden til celler begrænset [1]. For nylig opdagede forskere, at stamceller med egenskaber, der ligner ESC’er, kan fremstilles fra enhver celle i kroppen ved at tilføje specifikke molekyler, der sender signaler ind i cellerne. Disse celler kaldes inducerede pluripotente stamceller (iPSC’er) [2]. iPSC’er er nyttige, fordi de har alle de samme funktioner som ESC’er, men de kan fremstilles af en persons egne celler [3]. Desuden kan iPSC’erne fremstilles af hudceller, som er nemme at få fat i uden behov for kirurgi, og der er masser af hudceller til rådighed.
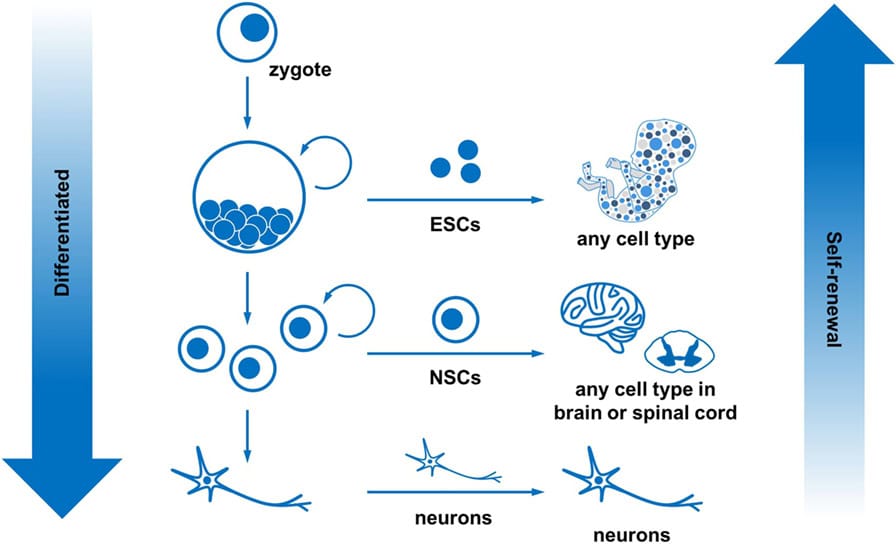
Neurale stamceller findes normalt i hjernen og rygmarven. NSC’er er specialiserede stamceller, der kan differentiere sig til celletyper i centralnervesystemet, herunder neuroner og gliaceller (figur 2). Forskere har nu fundet måder at bruge ESC’er og iPSC’er til at lave NSC’er, igen ved at bruge molekyler, der sender specifikke signaler ind i cellerne (figur 3). Spændende forskning i de sidste par år har også afdækket måder, hvorpå man kan lave NSC’er direkte fra enhver anden celle i kroppen uden at gå gennem iPSC-stadiet – disse kaldes direkte omprogrammerede NSC’er. Direkte omprogrammerede NSC’er kan laves ved hjælp af kemiske blandinger eller ved at redigere cellens DNA. Det er meget spændende, for det betyder, at vi har en næsten ubegrænset forsyning af NSC’er, som kan blive til de neuroner og gliaceller, der er nødvendige for at reparere centralnervesystemet.
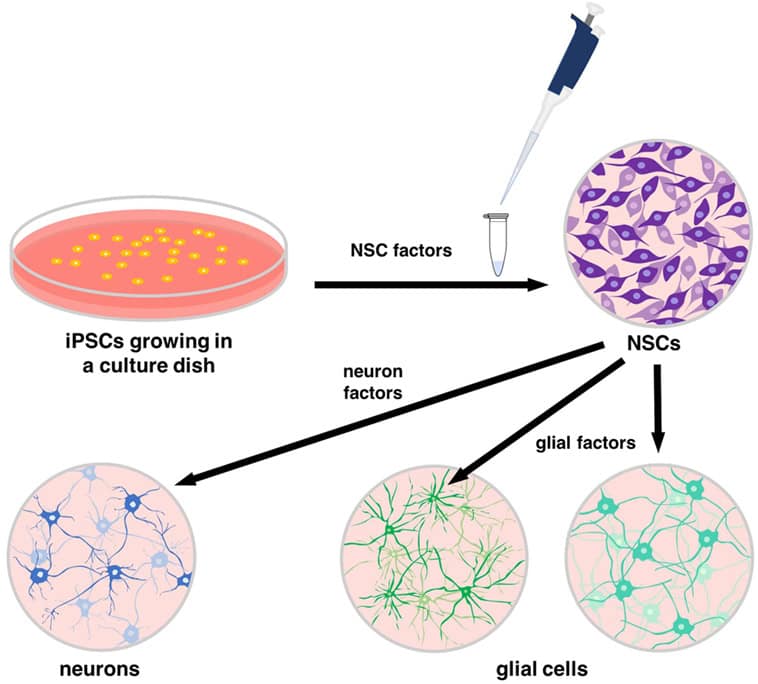
Alle celler i kroppen er et produkt af celledelinger, der er startet fra den allerførste celle, som kaldes en zygote (figur 2). Zygoten deler sig, og derefter deler hver af de nye celler sig, og det sker kontinuerligt, indtil alle kroppens celler er dannet. Cellerne i kroppen er en blanding af stamceller og specialiserede celler, der har differentieret sig. I centralnervesystemet bliver pluripotente stamceller til NSC’er og derefter til neuroner og gliaceller. Denne komplekse proces styres af en række meget specifikke proteiner, som binder sig til DNA-områder og som følge heraf påvirker andre proteiners funktion [4]. Alle disse interaktioner resulterer i ændringer af cellernes identitet. For at generere de korrekte typer af neuroner i centralnervesystemet skal disse proteiner udtrykkes i et bestemt mønster og en bestemt kombination. For at lave neuroner in vitro (i laboratoriet, i en dyrkningsskål), skal vi kopiere alle de trin og den timing, der finder sted in vivo (i kroppen). For at gøre dette fremstiller forskere iPSC’er fra en patients celler (oftest hud- eller blodceller) [2]. Derefter differentieres disse celler in vitro til NSC’er ved hjælp af de samme signalproteiner og -molekyler, som findes in vivo. Herefter renses NSC’erne og får lov til at dele sig, indtil der er et stort antal af dem. Derefter tilføjes nye signalmolekyler og proteiner, som igen efterligner det, der sker i kroppen, for at differentiere cellerne til neuroner og gliaceller. Hele processen kræver flere måneder med nøje planlagte trin. På hvert trin kontrolleres cellernes identitet ved hjælp af forskellige teknikker for at sikre, at differentieringsprocessen forløber som forventet. Det endelige celleprodukt kan bruges i laboratoriet til at undersøge skader i nervesystemet eller som en del af kliniske forsøg (omhyggeligt overvågede eksperimenter med frivillige patienter).
Inducerede pluripotente stamceller er en nyttig cellekilde, fordi de kan fremstilles af celler fra den samme person, som de skal bruges til at behandle (disse kaldes autogene iPSC’er). Fordi dette forskningsområde er så nyt, er de første kliniske forsøg med autogene iPSC’er stadig på planlægningsstadiet. Vi kan dog stadig bruge iPSC-celler til at undersøge flere vigtige ting i laboratoriet. For eksempel bruges iPSC’er og de neuroner, der fremstilles af dem, til at studere neurodegenerative sygdomme som Alzheimers sygdom, Parkinsons sygdom, traumatiske skader og depression in vitro. Når celler bruges i laboratoriet til at studere en sygdom, der normalt forekommer i kroppen, kaldes det en sygdomsmodel. Denne type cellemodeller er vigtige, fordi de kan laves af menneskeceller, som er lettere at få fat i og billigere at bruge end celler fra dyr. Faktisk brugte en nylig undersøgelse iPSC’er fra patienter med Alzheimers sygdom og lavede dem til en tredimensionel cellemodel [5]. Forskerne viste, at der sker en ophobning af unormalt protein i cellemodellen, som svarer til det, der sker i in vivo-sygdommen. Så ved hjælp af modellen kan forskellige behandlingsmidler testes på disse unormale celler for at identificere de bedst mulige behandlinger.
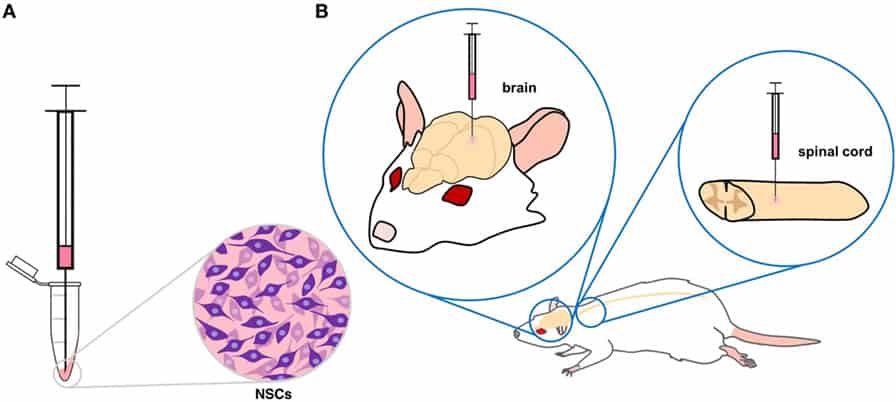
Neuroner fra stamceller er også ved at blive udviklet til celleerstatningsterapier, der skal testes i dyremodeller af sygdomme. For eksempel transplanterer forskere NSC’er fremstillet af iPSC’er ind i rotter for at reparere rygmarven efter skader (figur 4). Det har givet forskerne mulighed for at afdække og løse nogle vigtige problemer, før stamcellerne bruges i kliniske forsøg på mennesker. Dyremodellerne har også givet forskerne mulighed for at kombinere forskellige behandlinger med stamceller for at opnå de bedst mulige resultater [6]. Nogle af de problemer, som forskerne nu arbejder på, er at forbedre stamcellernes overlevelse efter transplantation og at finde ud af, hvordan man kan få de transplanterede celler til at skabe forbindelser med patientens neuroner [7.]
Siden opdagelsen af metoder til at omdanne ESC’er og iPSC’er til NSC’er og neuroner har der været stor spænding om, hvordan dette kan bruges til at behandle sygdomme i hjernen og rygmarven. I løbet af de næste 10-20 år forventer vi, at forskerne vil finde ud af, hvordan man får NSC’er og neuroner til at overleve bedre, efter at de er blevet transplanteret ind i patienter. Vi forventer også, at der vil blive fundet nye metoder til at skabe forbindelser mellem de transplanterede celler og neuronerne hos den person eller det dyr, der behandles. Denne udvikling kan gøre det muligt for os at bruge stamceller til at behandle sygdomme som Parkinsons sygdom, Alzheimers sygdom, multipel sklerose, traumatisk hjerneskade, slagtilfælde, rygmarvsskade og en lang række andre problemer, der påvirker mennesker. Men målet på om at behandle disse sygdomme med succes kan ikke nås af en enkelt person. At finde stamcellebaserede behandlinger til alle disse forskellige problemer vil kræve teamwork fra mennesker over hele verden, herunder forskere, læger, regeringer, der finansierer forskning, patienter, der er villige til at deltage i kliniske forsøg, og virksomheder, der vil hjælpe med at dyrke et stort antal stamceller. Denne indsats kan også bruge hjælp fra den næste generation af unge forskere, som kan bringe nye ideer til feltet og hjælpe med at skubbe denne forskning fremad.
Neuroner: Den vigtigste kommunikerende celletype i centralnervesystemet.
Det centrale: Det organsystem, der styrer alle vores tanker og handlinger; hjernen og rygmarven.
Stamceller: Specialiserede celler, der kan formere sig og blive til forskellige celletyper.
Gliaceller: Celler i centralnervesystemet, der omgiver neuroner for at give støtte, beskyttelse og næringsstoffer.
Self: At være i stand til hele tiden at lave nye kopier af sig selv.
Differentiere: At forvandle sig til andre celletyper.
Pluripotent: Evnen til at differentiere sig til enhver celletype i kroppen.
Induceret: Stamceller, der fremstilles fra enhver celletype i kroppen ved at tilføje specifikke signalmolekyler.
Neural: Stamceller, der kan forny sig selv, men som kun kan differentieres til celler i centralnervesystemet.
In vitro: I laboratoriet, i en kulturskål.
In Vivo: I kroppen.
[1] Mothe, A. J., og Tator, C. H. 2013. Gennemgang af transplantation af neurale stam-/progenitorceller til rygmarvsskade. Int. J. Dev. Neurosci. 31:701–13. doi:10.1016/j.ijdevneu.2013.07.004
[2] Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., et al. 2007. Induktion af pluripotente stamceller fra voksne humane fibroblaster ved hjælp af definerede faktorer. Cell 131:861-72. doi:10.1016/j.cell.2007.11.019
[3] Khazaei, M., Ahuja, C. S., og Fehlings, M. G. 2016. Inducerede pluripotente stamceller til traumatisk rygmarvsskade. Front. Cell. Dev. Biol. 4:152. doi:10.3389/fcell.2016.00152
[4] Sadler, T. W. 2005. Embryologi for udvikling af neuralrøret. Am. J. Med. Genet. C Semin. Med. Genet. 135C:2–8. doi:10.1002/ajmg.c.30049
[5] Lee, H. K., Velazquez Sanchez, C., Chen, M., Morin, P. J., Wells, J. M., Hanlon, E. B., et al. 2016. Tredimensionel human neuro-spheroid model af Alzheimers sygdom baseret på differentierede inducerede pluripotente stamceller. PLoS One 11:e0163072. doi:10.1371/journal.pone.0163072
[6] Zweckberger, K., Ahuja, C. S., Liu, Y., Wang, J. og Fehlings, M. G. 2016. Selvsamlende peptider optimerer det posttraumatiske miljø og forbedrer synergistisk effekten af neural stamcelleterapi efter cervikal rygmarvsskade. Acta Biomater. 42:77–89. doi:10.1016/j.actbio.2016.06.016
[7] Ahuja, C. S., Wilson, J. R., Nori, S., Kotter, M. R. N., Druschel, C., Curt, A., et al. 2017. Traumatisk rygmarvsskade. Nat. Rev. Dis. Primers 3:17018. doi:10.1038/nrdp.2017.18
Mennesker har lavet musik i titusinder af år. Men hvad sker der i din hjerne, når du lytter til dit yndlingsband eller din yndlingsmusiker? I denne artikel følger du lydens rejse fra ørerne til hjernen, hvor forskellige områder arbejder sammen, mens du lytter til musik. Musik involverer mange hjernefunktioner, såsom lydbehandling, hukommelse, følelser og bevægelse. Du vil også opdage, at hjernen kan lære at genkende velkendte mønstre i musik, hvilket kan hjælpe med at forklare, hvorfor musik kan gøre os glade, triste eller endda ophidsede. Til sidst vil du udforske, hvad der sker i musikeres hjerner, når de spiller på deres instrumenter.
…Kunstig intelligens (AI) systemer bliver ofte rost for deres imponerende præstationer inden for en lang række opgaver. Men mange af disse succeser skjuler et fælles problem: AI tager ofte genveje. I stedet for virkelig at lære, hvordan man udfører en opgave, bemærker den måske bare enkle mønstre i de eksempler, den har fået. For eksempel kan en AI, der er trænet til at genkende dyr på fotos, stole på baggrunden i stedet for selve dyret. Nogle gange kan disse genveje føre til alvorlige fejl, såsom en diagnose fr , der er baseret på hospitalsmærker i stedet for patientdata. Disse fejl opstår selv i avancerede systemer, der er trænet på millioner af eksempler. At forstå, hvordan og hvorfor AI tager genveje, kan hjælpe forskere med at designe bedre træningsmetoder og undgå skjulte fejl. For at gøre AI mere sikker og pålidelig skal vi hjælpe den med at udvikle en reel forståelse af opgaven – ikke bare gætte ud fra mønstre, der har fungeret tidligere.
…Er du nogensinde faldet og slået hovedet, mens du legede? Følte du dig lidt svimmel og havde ondt i hovedet? Hvis ja, kan du have fået en hjernerystelse! Hjernerystelser kan ske hvor som helst. De kan ske under sport, når du leger med dine venner eller endda når du cykler med dine forældre. Det kan være svært at vide, om du har fået en hjernerystelse. Mange børn og forældre er ikke sikre på, hvad de skal gøre, hvis nogen får en hjernerystelse. Læger og forskere ved, at det hjælper dig med at komme dig hurtigere, hvis du gør det rigtige efter en hjernerystelse. Denne artikel forklarer, hvad en hjernerystelse er. Den hjælper dig med at se, om du eller en ven har fået en hjernerystelse, og fortæller dig, hvad du skal gøre, hvis du nogensinde får en hjernerystelse.
…Hjertet er en meget vigtig muskel, der arbejder uafbrudt for at pumpe blod og levere vigtige næringsstoffer og ilt til alle dele af kroppen. Denne artikel ser på, hvordan hjertet fungerer normalt, og hvad der sker, når det fungerer unormalt, som det er tilfældet med en tilstand kaldet atrieflimren (AF). AF er en almindelig tilstand, der opstår, når hjertet slår uregelmæssigt og ude af takt. AF kan øge en persons risiko for at udvikle alvorlige problemer som hjertesvigt eller slagtilfælde. Denne artikel ser også på, hvordan AF kan diagnosticeres, hvad der forårsager AF, og de forskellige måder, det kan behandles på.
…