Forfattere
At forstå kommunikationen mellem nervecellerne i hjernen er nøglen til at forstå, hvordan hjernen fungerer. Kommunikation mellem nerveceller involverer kemiske beskeder, der sendes fra en celle og omsættes til elektrisk aktivitet i den modtagende celle. Denne elektriske aktivitet er nervecellernes og hele hjernens centrale sprog. Hvordan resulterer en kemisk besked, der frigives i én celle, i elektrisk aktivitet i en anden nervecelle, og hvordan har vi opdaget det? Lad os sammen dykke ned i den elektrificerende verden af nervecellekommunikation. Jeg vil fortælle dig om vores eksperimenter, som gjorde det muligt for os at finde den mest grundlæggende komponent i elektrisk aktivitet i hjernen – ionkanaler. Opdagelsen af ionkanaler banede vejen for at forstå oprindelsen af elektrisk aktivitet i hjernen og andre organer som hjertet. Denne opdagelse gav ny indsigt i udviklingen af lægemidler til behandling af forskellige elektrisk relaterede sygdomme, såsom epilepsi og hjertefrekvensforstyrrelser.
Professor Bert Sakmann modtog Nobelprisen i fysiologi eller medicin i 1991, sammen med Erwin Neher, for deres opdagelser af funktionen af enkelte ionkanaler i celler.
Din krop og alle andre levende kroppe er lavet af celler – livets grundlæggende byggesten. Hver celle er både en individuel enhed med sine egne uafhængige funktioner og en del af hele den flercellede organisme (som hjernen og hjertet), som skal fungere på en koordineret måde. Hver celle er omgivet af en klar fysisk grænse, kaldet cellemembranen, som adskiller cellens indhold fra det ydre (ekstracellulære) miljø og fra andre celler. Membranen gør det muligt for hver celle at have et defineret indre miljø og at udføre sine egne specialiserede funktioner. Men da de enkelte celler er en del af en større struktur, er de fleste celler – og især nerveceller – nødt til at kommunikere med andre celler. Hvordan kommunikerer celler med hinanden, hvis de er adskilt af en celle-membran-barriere? Der er flere mekanismer, der gør det muligt for celler at kommunikere med hinanden. En af de mest almindelige måder, og den måde vi vil fokusere på her, er, at en celle sender et kemisk signalstof til modtagercellen [1]. Ved at registrere dette stof “ved” modtagercellen, at der er blevet sendt et signal til den fra en anden celle, og modtagercellen reagerer derefter.
Nerveceller hjernens elementære byggesten, “taler” elektricitetens sprog. På ethvert givet tidspunkt udviser hver nervecelle en specifik elektrisk aktivitet, der producerer et sæt korte elektriske impulser kaldet spikes. Sammen med andre store netværk af aktive nerveceller skabes der en hel “elektrisk symfoni” i hjernen. Denne elektriske aktivitet i store netværk af nerveceller i vores hjerne er korreleret med alle aspekter af vores adfærd og oplevelse; vores handlinger, tanker, følelser og erindringer.
Hvordan kommunikerer nerveceller med hinanden for at skabe en så koordineret “elektrisk symfoni”? Kommunikationen mellem nerveceller er mere kompleks end kommunikationen mellem andre celletyper, da den omfatter både kemiske og elektriske komponenter. Denne kommunikation sker på et specifikt kontaktsted mellem cellerne kaldet synapse, og består af to grundlæggende trin. Først udskiller (udsender) afsendercellen et kemisk stof, kaldet en neurotransmitter [1], ind i det ekstracellulære rum (et hul) mellem afsender- og modtagercellerne. Når neurotransmitteren ankommer (via diffusion) i modtagercellen, binder den sig til specifikke receptorer, og som følge heraf begynder ioner at strømme over cellens membran. Som et resultat genereres der elektrisk aktivitet i modtagercellen (figur 1).
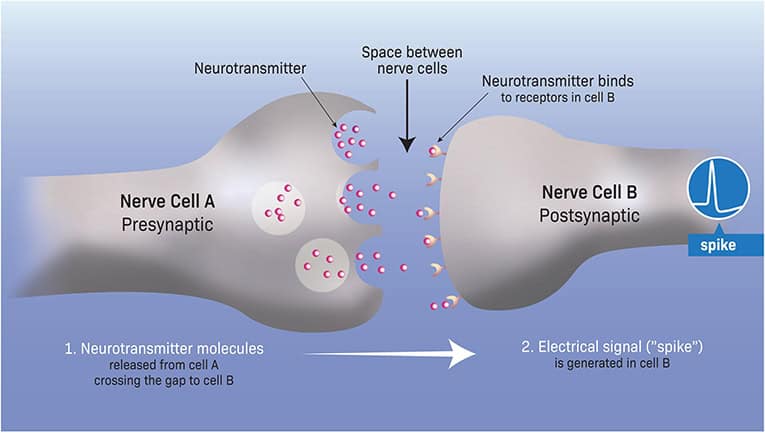
De fleste af de elektriske strømme i hjernen genereres af en lille gruppe ioner-især fire. Tre af disse ioner er positivt ladede (natrium-Na+ , kalium-K+ , og calcium-Ca++ ), og en er negativt ladet (klorid-Cl– ). Disse ioner kan komme ind eller ud gennem nervecellernes membraner. Når de gør det, ændrer de det elektriske potentiale, mellem de to sider af cellens membran. Disse hurtige ændringer i det elektriske potentiale på tværs af nervemembranen ligger til grund for genereringen af det grundlæggende elektriske “ord” (eller “bit”), som nerveceller bruger; de elektriske signaler kaldet spikes (figur 1). Du kan tænke på en spike som et meget kort lyn – en kort (1 ms, hvilket er 1/1.000 af et sekund) og lillebitte (en tiendedel af en volt eller 100 millivolt) elektrisk puls, der opstår i nerveceller, når de er aktive.
Hvordan krydser disse ioner nervecellernes membranbarriere for at generere elektrisk aktivitet? Og hvordan omsættes den neurotransmitter, der frigives fra en celle, til elektrisk aktivitet i modtagercellen? Der må være en vej for ionerne til at krydse den ellers isolerende membran i modtagercellen. Da jeg begyndte at studere dette felt, var den mekanisme, hvormed ioner bevæger sig gennem nervecellemembraner, ikke klar.
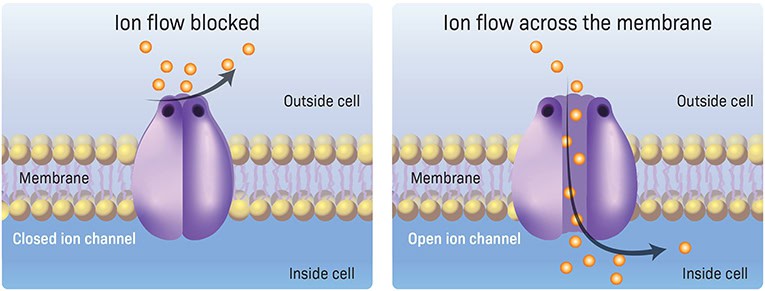
Ved hjælp af en særlig eksperimentel teknik, som jeg udviklede sammen med min kollega, professor Erwin Neher [2], fandt vi ud af, at ioner faktisk passerer mellem de to sider af membranen i henhold til deres kemiske gradienter. Vi fandt ud af, at ioner krydser membranen gennem små “huller” i membranen, kaldet porer. Disse porer er proteiner, der fungerer som kanaler, der forbinder ydersiden og indersiden af cellen. Da ioner er de stoffer, der passerer gennem disse porer, kaldes de ionkanaler, (figur 2). Vi fandt ud af, at ionkanaler åbner og lukker hurtigt som reaktion på neurotransmittere. Åbning og lukning af specifikke ionkanaler (f.eks. kanaler, der er specifikke for Na+ ioner eller K+ ioner) muliggør strømmen af ioner over cellemembranen. Denne strøm ændrer til gengæld det elektriske potentiale på tværs af membranen. Som svar genererer modtagercellen en gnistrende spike – det grundlæggende elektriske “ord” i hjernen.
Da professor Neher og jeg begyndte at studere ionflow i nerveceller, overvejede vi to primære ion-transportmekanismer, som kunne være i spil. Den første mekanisme involverede et transportmolekyle. Ifølge denne idé “fanger” specifikke molekyler i membranen en ion ad gangen, fører den fra ydersiden af cellen til indersiden og frigiver den der. Denne mekanisme var kendt fra andre kropslige processer, f.eks. energiproduktion, hvor næringsstofmolekyler passerer over cellemembranen via transportmolekyler.
Den anden mulige mekanisme, som vi overvejede, og som senere blev bekræftet af vores eksperimenter, var, at der findes ionkanaler i membranen for specifikke ioner. Disse kanaler kan enten være åbne eller lukkede. Når de er åbne, kan der flyde strøm mellem de to sider af membranen, hvilket forbinder cellens ydre miljø med dens indre miljø (figur 2). For at undersøge, om denne mekanisme er ansvarlig for transporten af ioner ind og ud af celler under dannelsen af pigge, var vi nødt til at studere den elektriske aktivitet, der opstår, når ioner krydser membranen gennem individuelle ionkanaler. For at gøre dette måtte vi isolere et meget lille område, eller “lap”, af nervecellens membran i håb om at måle den elektriske strøm, der passerer gennem en enkelt ionkanal, der måtte findes i denne lille lap. Hvis der fandtes ionkanaler, ville vi forvente at måle et bestemt mønster af elektrisk aktivitet svarende til åbningen og lukningen af ionkanalen, hvilket er anderledes end det elektriske mønster, der forventes, hvis transportmolekyler blev brugt til at flytte ioner over membranen.
For at udføre denne form for strømmåling var vi nødt til at overvinde to hovedudfordringer. For det første skulle vi måle ioner, der strømmer over membrankanalen i det lille stykke membran uden at miste noget af denne strøm. Det er svært, for hvis optageenheden ikke er tæt forseglet til membranen, kan ioner, der krydser membranen gennem kanalen, undslippe sidelæns, før de kommer ind i optageenheden. Vi var derfor nødt til at sikre os, at de ioner, der krydsede membranen, blev tvunget til at strømme gennem detektoren.
Den anden udfordring var at skelne mellem to typer strømme, der flyder gennem nervecellemembranen. Det viste sig, at membranen altid er elektrisk aktiv – et fænomen, der kaldes baggrundsstøj. Baggrundsstøj optræder som konstant elektrisk aktivitet, der er forskellig fra den elektriske aktivitet, der er relateret til strømmen af ioner gennem membranen som reaktion på neurotransmittere. Baggrundsstøjen kan være meget stor sammenlignet med den strøm, vi ønskede at måle fra åbningen af individuelle membrankanaler. Derfor var vi nødt til at finde en måde at reducere baggrundsstøjen på, så den ikke overdøvede (eller “maskerede”) den strøm, der løber gennem de enkelte ionkanaler.
Vi løste begge udfordringer ved at bruge et meget tyndt glasrør kaldet en pipette med en spids på omkring en mikrometer (1/1.000 af en millimeter) i diameter (figur 3A). Den anden ende af pipetten har et amperemeter, som måler elektrisk strøm. Pipettens spids presses kraftigt mod et lille stykke af cellens membran, og der suges, så der skabes en meget tæt kontakt mellem pipettens spids og membranen for at sikre, at der ikke kan ske lækage af ioner. Optagelser fra et så lille stykke af membranen reducerede også baggrundsstøjen og forbedrede derfor optagelsen af strømmen af ioner gennem ionkanalen.
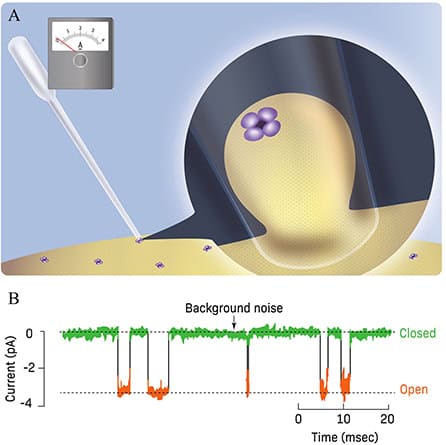
Når der ikke var nogen neurotransmitter til stede, fandt vi ud af, at der ikke gik nogen strøm gennem kanalen, og der blev kun observeret mindre baggrundsstøj (figur 3B). Når en neurotransmitter binder sig til membranen, åbnes ionkanalen meget hurtigt, på en trinlignende måde, hvilket muliggør strømmen af en lille strøm på nogle få picoampere1 på tværs af membranen [2-4]. Når neurotransmitteren ikke længere var bundet til membranen, lukkede kanalen igen (figur 3B). Vi fandt ud af, at ionkanalen kun forblev åben eller lukket i millisekunder (et millisekund er 1/1.000 af et sekund), og at både varigheden af den åbne tilstand og tidsintervallet mellem kanalens åbninger varierede på grund af den sporadiske binding af neurotransmittermolekyler. Som du kan se i figur 3B, var amplituden af strømmen, når den flød gennem den åbne kanal, ret konstant.
Efter at have målt den lille strøm, der flød gennem membranstykket, og foretaget nogle beregninger, anslog vi, at omkring 10.000 ioner krydsede det lille stykke membran hvert millisekund. Det fortalte os, at åbningen af ionkanaler, snarere end transporten af ioner via transportmolekyler, er den mekanisme, der gør det muligt for ioner at krydse cellens membran! Transportmolekyler er for langsomme til at transportere ioner over membranen med en så høj hastighed. Dette var en vigtig opdagelse, da den bekræftede ionkanalernes eksistens og funktion som den grundlæggende mekanisme, der producerer den elektriske aktivitet, herunder spike, i nerveceller. Disse ionkanaler er også ansvarlige for genereringen af elektrisk aktivitet i andre “exciterbare” væv, såsom perifere muskler og hjertet.
Desuden var det vigtigt at forstå membranionkanalernes funktion, fordi mange neurologiske lidelser (såvel som lidelser i hjertet og andre kropsvæv) skyldes dysfunktioner i ionkanalerne. Derfor blev det nye udtryk “kanalopatier2” til at beskrive den (meget store) familie af sygdomme, der er forårsaget af defekter i ionkanalernes funktion. Baseret på opdagelsen af membranionkanaler og deres funktion blev min kollega, professor Erwin Neher, og jeg i 1991 tildelt Nobelprisen i medicin eller fysiologi.
Jeg vil starte med at fortælle dig det vigtigste, jeg har lært af min videnskabelige vejleder, professor Bernard Katz, som også modtog Nobelprisen i fysiologi eller medicin i 1970. Han lærte mig, at man skal være meget kritisk over for sine resultater og altid være klar til nye fund, der kan ugyldiggøre ens tidligere fund – hvor ubehageligt det end måtte være. Jeg prøver at give denne lektie videre til mine studerende og lære dem at være kritiske over for deres resultater. Især i biologisk væv er der mange påvirkninger, vi ikke kan kontrollere, og som skal tages i betragtning. Når mine studerende har gjort et nyt fund, råder jeg dem derfor til at holde det for sig selv i et stykke tid og gentage deres eksperimenter for at forsøge at afkræfte deres resultater igen og igen. De bør først offentliggøre deres resultater, når de er helt overbeviste om, at de er korrekte.
Ud fra et mere generelt livssyn er et godt liv efter min mening et liv, hvor du har noget at tænke over, som giver dig mulighed for at følge din nysgerrighed og måske opdage noget nyt. I andre menneskers perspektiv kan et godt liv betyde at tjene mange penge eller blive anerkendt af andre, og det er også helt fint. Jeg tror, at det at være forsker er det bedste valg, du kan træffe, men kun hvis du er nysgerrig på naturen. Du skal ikke prøve at blive forsker, fordi du tror, det er et glamourøst erhverv. Hvis du ikke brænder inde med trangen til at finde ud af ting, er det bedre at vælge et andet erhverv – et, der får dig til at brænde af spænding og lidenskab.
Yderligere materialer
Fodnoter
Nerveceller: De vigtigste cellulære byggeklodser i hjernen. Nerveceller genererer den elektriske aktivitet i hjernen.
Synapse: Et kontaktpunkt mellem to nerveceller, der består af et lille hul, hvor et kemisk stof – neurotransmitteren – passerer fra den afsendende celle (den præsynaptiske celle) til en modtagende celle (den postsynaptiske celle).
Neurotransmitter: Et kemisk stof, der frigives fra en nervecelle og modtages af en anden nervecelle, hvilket muliggør kommunikation mellem nerveceller.
Diffusion: En proces med spontan bevægelse, hvor partikler bevæger sig ukontrolleret fra et sted til et andet.
Ion: En partikel med enten en positiv eller negativ ladning.
Elektrisk potentiale: En forskel i ladning mellem to punkter, i vores tilfælde mellem de to sider af membranen. Ioner med positiv ladning vil strømme fra den mere positive side til den mindre positive side.
Kemisk gradient: En forskel i koncentrationen af et stof på tværs af steder. Stofferne, i vores tilfælde ioner i de to sider af membranen, bevæger sig “ned” ad gradienten, fra siden med den højeste koncentration til siden med den laveste koncentration.
Ionkanal: Et lille hul (pore) lavet af proteiner i cellemembranen, som, når det er åbent, muliggør passage af ioner ind og ud af cellen.
[1] Katz, B. 1971. Kvantitativ mekanisme for frigivelse af neurale transmittere. Videnskab. 173:123-6.
[2] Neher, E., og Sakmann, B. 1992. Patch clamp-teknikken. Sci. Am. 266:44-51.
[3] Hamill, O. P., og Sakmann, B. 1981. Flere konduktanstilstande af enkelte acetylcholinreceptorkanaler i embryonale muskelceller. Nature. 294:462-4.
[4] Bormann, J., Hamill, O. P., og Sakmann, B. 1987. Mekanisme for anionpermeation gennem kanaler gated af glycin og gamma-aminosmørsyre i musekulturerede spinalneuroner. J. Physiol. 385:243-86.
Mennesker har lavet musik i titusinder af år. Men hvad sker der i din hjerne, når du lytter til dit yndlingsband eller din yndlingsmusiker? I denne artikel følger du lydens rejse fra ørerne til hjernen, hvor forskellige områder arbejder sammen, mens du lytter til musik. Musik involverer mange hjernefunktioner, såsom lydbehandling, hukommelse, følelser og bevægelse. Du vil også opdage, at hjernen kan lære at genkende velkendte mønstre i musik, hvilket kan hjælpe med at forklare, hvorfor musik kan gøre os glade, triste eller endda ophidsede. Til sidst vil du udforske, hvad der sker i musikeres hjerner, når de spiller på deres instrumenter.
…Kunstig intelligens (AI) systemer bliver ofte rost for deres imponerende præstationer inden for en lang række opgaver. Men mange af disse succeser skjuler et fælles problem: AI tager ofte genveje. I stedet for virkelig at lære, hvordan man udfører en opgave, bemærker den måske bare enkle mønstre i de eksempler, den har fået. For eksempel kan en AI, der er trænet til at genkende dyr på fotos, stole på baggrunden i stedet for selve dyret. Nogle gange kan disse genveje føre til alvorlige fejl, såsom en diagnose fr , der er baseret på hospitalsmærker i stedet for patientdata. Disse fejl opstår selv i avancerede systemer, der er trænet på millioner af eksempler. At forstå, hvordan og hvorfor AI tager genveje, kan hjælpe forskere med at designe bedre træningsmetoder og undgå skjulte fejl. For at gøre AI mere sikker og pålidelig skal vi hjælpe den med at udvikle en reel forståelse af opgaven – ikke bare gætte ud fra mønstre, der har fungeret tidligere.
…Er du nogensinde faldet og slået hovedet, mens du legede? Følte du dig lidt svimmel og havde ondt i hovedet? Hvis ja, kan du have fået en hjernerystelse! Hjernerystelser kan ske hvor som helst. De kan ske under sport, når du leger med dine venner eller endda når du cykler med dine forældre. Det kan være svært at vide, om du har fået en hjernerystelse. Mange børn og forældre er ikke sikre på, hvad de skal gøre, hvis nogen får en hjernerystelse. Læger og forskere ved, at det hjælper dig med at komme dig hurtigere, hvis du gør det rigtige efter en hjernerystelse. Denne artikel forklarer, hvad en hjernerystelse er. Den hjælper dig med at se, om du eller en ven har fået en hjernerystelse, og fortæller dig, hvad du skal gøre, hvis du nogensinde får en hjernerystelse.
…Hjertet er en meget vigtig muskel, der arbejder uafbrudt for at pumpe blod og levere vigtige næringsstoffer og ilt til alle dele af kroppen. Denne artikel ser på, hvordan hjertet fungerer normalt, og hvad der sker, når det fungerer unormalt, som det er tilfældet med en tilstand kaldet atrieflimren (AF). AF er en almindelig tilstand, der opstår, når hjertet slår uregelmæssigt og ude af takt. AF kan øge en persons risiko for at udvikle alvorlige problemer som hjertesvigt eller slagtilfælde. Denne artikel ser også på, hvordan AF kan diagnosticeres, hvad der forårsager AF, og de forskellige måder, det kan behandles på.
…